科学家揭示了转录如何驱动基因组内的运动
一组科学家发现了基因活动、基因组包装和全基因组运动之间令人惊讶的联系,揭示了基因组组织直接影响基因调控和表达的各个方面。
发表在《自然通讯》(Nature Communications)杂志上的这一发现,加强了对单基因转录依赖运动背后机制的理解——单基因转录依赖运动的功能障碍可能导致神经系统和心血管疾病以及癌症。
“基因组被单个基因的转录驱动运动‘搅动’了,”纽约大学物理学教授、该研究的资深作者亚历山德拉·齐多夫斯卡(Alexandra Zidovska)解释说。
“基因的移动方式不同,取决于它们是否被读取,这导致了人类基因组复杂、动荡的运动。了解细胞核中单个基因转录依赖运动背后的机制,可能对理解人类健康和疾病基因组至关重要。”
人类基因组由2米(6.5英尺)长的DNA组成,这些DNA被包裹在细胞内直径仅为10微米的细胞核中,比基因组DNA的长度还小10万倍。DNA分子为所有细胞过程和功能编码信息,基因作为信息单位。
不同的基因被读取,它们的信息在不同的时间被处理。当一个基因被读取时,有一种分子机制进入它,并将其信息转录成mRNA分子,这一过程被称为转录。
Zidovska和她的同事们之前已经发现,基因组经历了很多“搅拌”或运动,导致其在细胞核中的重组和重新定位。
然而,人们对这些运动的起源知之甚少。科学家们假设,由三磷酸腺苷(ATP)分子驱动的分子马达是驱动因素,ATP分子为许多生物过程提供能量。
这些主动马达被认为对DNA施加作用力,从而导致DNA和核质(其周围的液体)运动。但其背后更大的物理机制仍然难以捉摸。
考虑到这一点,Zidovska和她的同事们专注于RNA聚合酶ii——负责转录和细胞核中最丰富的分子马达之一。当一个基因是活跃的,即积极转录时,负责的分子机制在其加工过程中对DNA施加力。
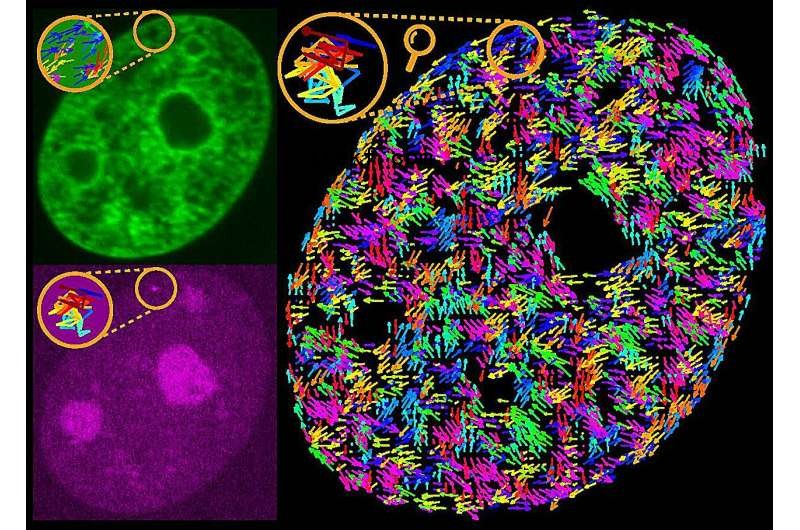
《自然通讯》的研究调查了在活的人类细胞中,单个活跃转录基因的运动如何影响其周围基因组的运动。
为此,作者采用CRISPR技术荧光标记单个基因,双色高分辨率活细胞显微镜观察这些标记基因的运动,位移相关光谱(DCS)同时绘制基因组在细胞核中的流动。
然后通过物理和数学分析处理高分辨率成像数据,揭示了基因如何在细胞内移动的从未见过的物理图像。
在他们的研究中,研究人员首先检查了这些基因在不活跃时的运动,然后“打开”这些基因,观察它们在“活跃”时的运动变化。与此同时,作者使用DCS绘制了周围基因组的流动图,监测基因激活前后基因组在细胞核中的流动情况。
与超过10万名依赖Phys.org获取每日见解的订阅者一起探索最新的科学、技术和太空。注册我们的免费时事通讯,获取每日或每周重要的突破、创新和研究的最新信息。
总的来说,作者发现,活跃的基因有助于基因组的搅拌运动。通过同时绘制单基因和全基因组运动的图谱,他们揭示了基因组的密实影响了基因的作用方式。
具体来说,一项运动相关分析表明,在低压实区域,单个活性基因驱动基因组的运动,而在高压实区域,无论其活性状态如何,基因组都驱动基因的运动。
“通过揭示基因活动、基因组压缩和全基因组运动之间的这些意想不到的联系,这些发现揭示了基因组时空组织的各个方面,这些方面直接影响了基因的调节和表达,”Zidovska说。
这项工作也增加了我们对物理学的理解。
她说:“这项研究为活跃系统和生命系统的物理学提供了新的见解。”“通过揭示活跃生命系统的突现行为,比如人类基因组,它教会了我们新的物理学。”
该论文的其他作者是纽约大学博士生朱方毅(Fang-Yi Chu)和Alexis S. Clavijo,以及纽约大学博士后研究员Suho Lee。
